Kemiallinen sidos ja sen muodostumisen periaate
Kemiallinen sidos on melko monimutkainen käsite,joka muodostettiin pitkään perustuen atomien rakenteen opetuksiin ja ideoihin. Niin, XVI-XVII vuosisatoja. olivat ensimmäisiä yrityksiä selittää kemiallinen samankaltaisuus corpusculaarisen teorian pohjalta. R. Boyle, ajatteli, että kemiallisten reaktioiden liikkeellepaneva voima on hiukkasten yhteensopivuus, kuten avainlukko, eli "kerätyt" ja "puretut" atomit, jotka muodostavat uusia aineita. Myöhemmin XVIII vuosisadalla. mekaanisen teorian korvaamisesta tulee dynaaminen, jonka kannattaja oli I. Newton. Hän uskoi, että kemiallisen samankaltaisuuden syy ovat voimakkaan vetovoiman voimat.
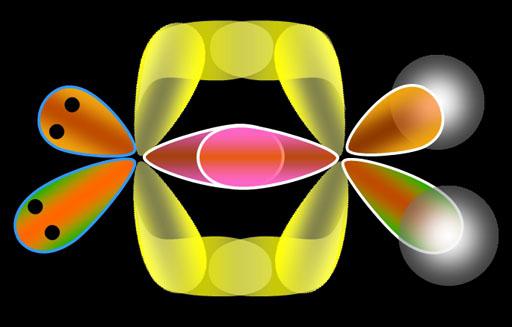
Yhteyden sähköinen luonne selitetään atomin avullavety. Tiedetään, että se sisältää yhden parittoman elektronin, joka on ensimmäisellä energiatasolla. Kun kaksi vetyatomia konvergoituvat, jonkin toisen ydin alkaa houkutella toisen elektroneja ja päinvastoin. Atomeiden välinen vuorovaikutus tapahtuu atomien välillä, niiden välinen etäisyys pienenee, keskinäistä vetovoimaa tasapainotetaan ydinvoiman hylkimisellä. Muodostuneessa molekyylissä elektroni- tiheys kasvaa.
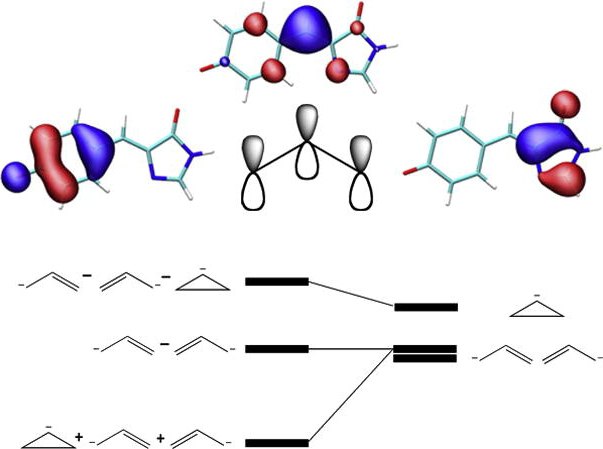
Kuitenkaan kaikki atomit eivät ole vuorovaikutuksessa toistensa kanssa. Siten inerttien kaasujen elektroniset kuoret eivät pääse päällekkäin, ts. ne pysyvät vakaina. Tämän säännön perusteella muotoiltu oktettia Lewis, jossa todetaan, että kaikki atomit elementtien kemiallisen sidoksen muodostumisen taipumus muuttaa sähköisen kuori kokoonpano lähimpään inerttiä kaasua, tai liittämällä antamalla elektroneja.

Kaiken edellä esitetyn perusteella voit tehdäjohtopäätös, että kemiallinen sidos on atomien vuorovaikutus, joka tapahtuu elektronien vaihdon tai niiden siirtyessä materiaalin alkuaineosasta toiseen.
</ p>
